6月16日起,山西医疗器械新规执行
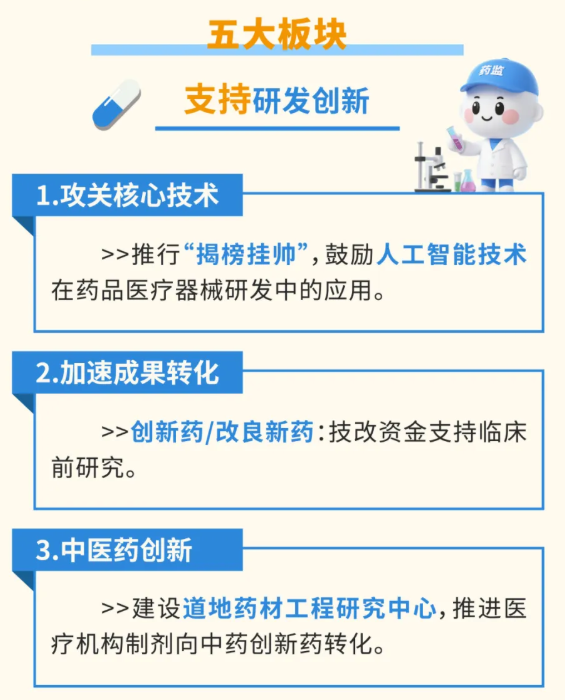
01山西创新医械新政出台研发、审批、进院、支付...
具体内容看,此次山西的《若干措施》覆盖创新医疗器械研发、审批、应用、监管等全流程,从资金支持到审批效率再到相应的主管部门,文件中都进行了明确划分。
例如,将符合条件的创新项目列入省级重点工程,帮助项目单位解决建设过程中的卡点、堵点,推动项目应投尽投。对第三类医疗器械研发和产业化项目,按照技改资金政策相关要求给予支持。
根据山西省政府新闻办新闻发布会介绍,对承担国家科技计划的项目,按国拨经费的5%进行奖励,每个项目最高奖励达100万元;对首次通过认定的高新技术企业奖励10万元,对连续两次通过认定的高新技术企业奖励20万元。
审批方面,加快临床急需医疗器械审批上市,对临床急需医疗器械产品,予以优先审评审批,审批时限由58个工作日压缩为30个工作日。
此外,对创新、首个、优先审评医疗器械产品开辟绿色通道,优先注册检验,对临床急需药品医疗器械实行即收即检,将注册类医疗器械检验时限压缩至20个工作日;对符合条件的罕见病用第二类创新医疗器械减免临床试验,优先审评审批。
《若干措施》明确提出,要加快创新药品医疗器械入院使用。推进“三医”协同治理创新,促进研发、生产同临床使用深度融合。 同时,加大创新药品医疗器械医保支持,研究规范医保医用耗材目录和医疗服务项目目录,按程序将符合条件的医疗器械纳入医保支付范围。 为了进一步提高市场覆盖范围,《若干措施》中还提出要优化医疗器械进出口支持,鼓励已在境内上市在境外生产的医疗器械转移山西省生产,并优化山西省医疗器械产品出口办理程序,拓宽医疗器械销售证明出具范围。
02创新器械支持全链条升级
留出价格窗口期,医保付费阻力减小
创新医疗器械在国内已迈入新的发展黄金期。
例如,在今年多个耗材集采项目中,都明确提到“省级及以上药品监督管理部门认定为创新医疗器械的,不纳入带量采购范围”,为创新器械商业转化留出了宝贵的窗口期。 DRG/DIP2.0方案对创新的积极影响也开始释放,以山东为例,2024年对5%的DRG付费病例和5‰的DIP付费病例组织专家评审,按规定对通过评审的特例单议病例追加支付金额18.65亿元。 浙江今年2月发文,要设立新药和创新医疗器械应用清单,在清单发布后1个月内,浙江省医疗机构根据临床需求和医院特色,将相应产品按“应配尽配”原则配备使用,或者根据需求设立临时采购绿色通道。 此外,国家层面还在政策端释放出创新医疗器械的新发展风向。 去年10月,工信部办公厅、国家卫健委办公厅发布《关于开展2024年高端医疗装备推广应用项目申报工作的通知》,将重点开展诊断检验、治疗、监护与生命支持、养老康复、人工智能辅助诊疗5个方向的高端医疗装备推广应用。 山西《若干措施》中也提到,鼓励将人工智能技术应用于药品医疗器械研发全过程,加速新技术、新产品落地应用。 政策组合拳密集落下,国产创新医疗器械爆发之日已经逼近。 附:





 售前咨询专员
售前咨询专员