【医疗器械 GMP 文件模板】高效落地!全流程文件控制程序助力质量管理体系规范化
在起草医疗器械GMP文件的时候,你会率先起草哪个文件呢?
我根据自己多年搭建质量管理体系的经验,写了一篇公众号文章《如何从0到1搭建医疗器械质量管理体系》,在编写文件时特别提出:首先编写的第一个文件就是《文件控制程序》。以下是《文件控制程序》模板,以模板为基础,结合企业实际情况进行相应的修改,可极大提升文件编写的效率和质量。
医疗器械文件控制程序
1、目的
建立文件控制程序,确保本公司质量管理体系文件的有效性、可靠性和适用性,保障产品质量。
2、适用范围
适用于公司所有与质量管理有关的文件。
3、职责
3.1质量部负责管理、监督各部门对文件的执行情况。
3.2各部门负责按照本文件的要求实施文件管理。
4、内容
4.1定义
本公司的GMP文件指的是所有与GMP活动相关的文件,包括质量手册、程序文件、作业指导书、岗位职责、工艺规程、质量标准、确认(验证)方案和报告、记录等。
4.2 文件的管理原则、编写原则
4.2.1 文件的管理原则(见表1)
表1 文件的管理原则
序号 | 文件的管理原则 |
1 | 文件应准确无误,必须使用最新版本;批准使用的文件是一切行为的准则,不得违背和随意修改;文件未经批准,不准私自翻印及外传。 |
2 | 质量部负责对纸质文件系统和电子文件系统的存档管理,通常由指定人员负责文件系统的管理工作,即文件管理员。 |
3 | 由于审核、执行检查的需要,文件系统的所有文件应分发质量部。 |
4.2.2 文件编写基本原则(见表2)
表2 文件编写基本原则
序号 | 内容要求 |
1 | 文字应确切、清晰、易懂,不能模棱两可。 |
2 | 文件起草由文件使用部门或责任部门负责起草/修订。 |
3 | 文件起草/修订必须符合国家相关法律法规、产品质量要求、公司规定。 |
4 | 文件应当标明题目、类别、目的以及文件编号、版本号等。 |
5 | 文件内容含有流程管理的部分,应采用流程图格式,减少文字描述。 |
6 | 文件的起草/修订严格按照文件编写格式、文字顺序要求执行。 |
7 | 文件的内容及项目顺序:【目的】、【适用范围】、【职责】、【内容】 |
4.3文件类别
表3 文件类别代码表
序号 | 文件类别 | 代码 | 序号 | 文件类别 | 代码 | ||
1 | 质量手册 | 5 | 岗位职责 | ||||
2 | 工艺规程 | 6 | 程序文件 | ||||
3 | 质量标准 | 原料 | 7 | 验证(确认) | 方案 | ||
成品 | |||||||
中间产品 | 报告 | ||||||
其它 | |||||||
4 | 作业指导书 | 8 | 记录文件 | REC | |||
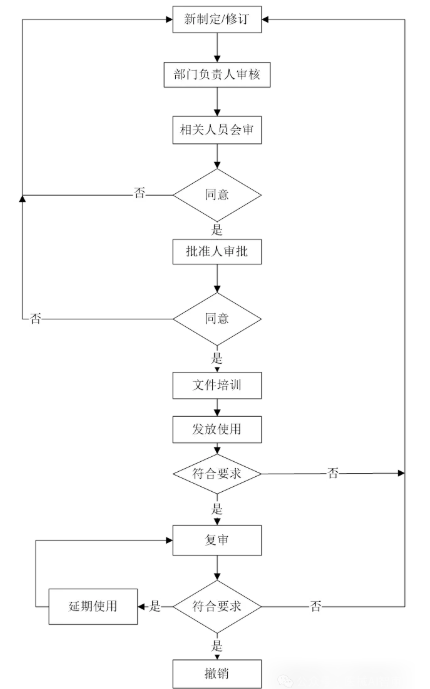
4.4文件的管理流程参见《文件管理流程图》
图1 文件管理流程图
4.5文件编制程序
4.5.1文件起草/修订:文件由各责任部门负责人指定人员编写或修订,文件的制定人一般应是文件内容描述的活动的主要执行人。
4.5.2文件审核:文件起草/修订后,由部门负责人或指定的人审核后,再由质量部和各相关部门经理或其指定人共同进行会审,并填写《文件审批会签表》。
4.5.2.1 会审方式 会审分会议审核和电子审核二种方式。
4.5.2.1.1会议审核方式:由文件起草部门、相关使用人及相关管理人员的代表集中开会进行讨论审查。
4.5.2.1.2 电子会审:由文件起草部门通过电子邮件、QQ群等方式,向相关部门的管理人员的代表发送需会审的文件电子版,确定会审时间要求。
4.5.2.2 GMP文件会审程序
4.5.2.2.1 文件起草完成后交部门负责人或主管,在2个工作日内完成审核。
4.5.2.2.2 文件经部门负责人或主管审核完成后,部门负责人组织相关部门人员会审。
4.5.2.2.3 无特殊说明或规定时,文件会审人应在收到文件会审通知后五个工作日内审核完毕,并回复审核意见,不能按时完成的,应向文件组织会审人说明情况,否则视为认可全部文件内容。
4.5.3 文件批准:经审定的文件,全部传至质量部QA处进行汇总,再由QA统一打印。各部门文件经制定人和审核人的签字,注明日期后交给批准人签字。文件的生效日期应考虑在生效之前有足够的时间进行培训,由批准人填写。
4.6文件编制责任人表
表4 文件责任表
文件类型 | 起草/修订人 | 审核人 | 批准人 |
质量手册 | 质量副总或指定人员 | ||
程序文件 | 部门使用人 | ||
工艺规程 | 技术员或车间主任 | ||
质量标准 | 部门使用人 | ||
岗位职责 | 岗位负责人 | ||
作业指导书 | 部门使用人 | ||
确认和验证方案(报告) | 验证小组组长 |
4.7文件形式
4.7.1 除特殊的记录文件,文件的每一页均应包括文件标题;所有文件的每一页均应包括页码,或注明合理的编号顺序。
4.7.2本公司GMP文件的形式以本文件为模板,应符合模板的要求。
4.8文件编号控制
4.8.1文件的编号是唯一的,由质量部控制文件的编号,在文件提请审批之前,文件制定人向质量部索取文件编号。
4.8.2 文件按照以下要求进行编号:
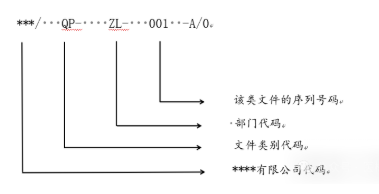
4.8.2.1文件编码的组成:企业名称代码/文件类型-部门代码-文件编号(001-999)-版本号。其中,文件类别参看4.3;部门代码指文件责任部门的代码,参看4.8.3.2;文件编号为流水号,从001开始。例如,文件编号“***/QP-ZL-001-A/0”表示***公司质量部的程序文件类第1个文件。初始文件版本为A/0,用A、B……Z,A、B等字母表示版本状态“A/0”为第一版,未作修订,“A/1”为第一版第1次修订。换版后按B、C等以此类推。如下图:
4.8.2.2部门分类及代号:
表5 部门代码表
部门名称 | 部门代码 | 部门名称 | 部门代码 |
行政部 | 生产部 | ||
仓储部 | 销售部 | ||
质量部 | 采购部 | ||
设备部 | 研发部 |
4.9文件培训:新编制文件和修订文件在生效日期之前,文件的制定部门应对相关部门的人员进行培训。
4.10 文件发放、收回、替换、撤消、销毁
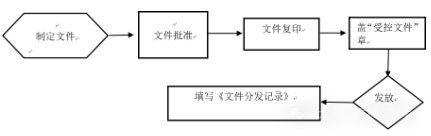
4.10.1文件发放:文件批准后,质量部应将签字纸版作为原版文件永久存档,并按照各部门所需进行复印和装订,文件应至少发放到文件内容涉及的相关部门处。原版文件复制时,不得产生任何差错,复制的文件应当清晰可辨。复印人员检查文件无误后,在复印件的每页纸张右上角盖“受控文件”章,填写《文件复印分发记录》。
图2文件的发放、复印流程图
4.10.2文件替换
破损文件的替换按照上述流程进行发放,分发号与原文件分发号相同,填写《文件分发记录》时应在备注中标明“破损”,文件管理员将破损文件收回替换时要注意替换文件的正确无误。
4.10.3 文件撤消、收回和销毁:QA在发放新版文件的同时,回收旧版文件,同时填写《文件回收销毁记录》,由部门负责人审核签字同意后,收回的作废文件在QA监督下进行销毁。
图3文件的回收、销毁

4.11文件修订或新增
4.11.1 文件系统改版或新增条件要求
表 6文件系统改版或新增条件要求
序号 | 改版条件 |
1 | 文件与现行相关法律、法规、医疗器械标准发生重大变化时。 |
2 | 当现行文件系统运行5年后,需要对现行文件进行整体的修订和提高时。 |
3 | 文件与实际操作不一致或不符合工作实际要求。 |
4.11.2 文件新增或修订程序
由申请部门填写《文件新增、修订申请表》,经部门负责人审核签字后,交质量部审核,并由QA确定文件编号及版本号。申请部门按4.5项完成文件修订工作。文件修订完成后,所有相关记录一并交QA存档保存。
4.12 文件的立卷、归类、保存的流程及要求
4.12.1 文件的立卷、归类、保存的流程
表7文件的立卷、归类、保存的流程
文件种类 | 流程要求 |
文件的立卷 | 起草部门负责各自文件的立卷,制定部门文件目录。 |
文件的归类 | 由起草部门负责各自文件的归类。 |
文件的保存 | 起草部门将已立卷、归类好的文件以及文件目录提交给质量部汇总,制定文件总目录,由质量部进行文件的保存。 |
4.12.2 文件保存原则及要求
4.12.2.1 文件保存原则:文件及记录要保存在适宜的环境下(防火、防潮、防虫蛀等),属计算机单独贮存的记录,要复制备份文件,以防原始记录丢失。
4.12.2.2 文件的保存
表8 文件的保存
文件保存的类别 | 要求 |
质量部负责 保存的文件 | 文件原件与电子版本,建立《现行文件目录》,在作废文件的原件(文件首页页眉文件名称右侧)加盖红色“作废”章后继续分类保存,并登记在《归档文件登记台帐》上。 |
各类产品批件、医疗器械补充申报资料、GMP跟踪检查资料、产品核查、医疗器械研究资料原件 | |
批生产记录、批检验记录、批包装记录、质量分析报告、质量事故调查报告、风险评估报告、产品相关考察报告。 | |
各类产品批件、医疗器械补充申报资料、GMP跟踪检查资料、产品核查、医疗器械研究资料等,质量部存档一份复印件。 | |
使用部门保存 | 其它辅助记录。 |
电子记录(磁带、微缩胶卷、设备运行记录等),应备份。 | |
各部门对领发到的受控文件指定专人负责保管,并建立《现行文件目录》。 |
4.12.2.3 文件保存时限表
表9文件保存时限表
文件类别 | 保存时限要求 |
批生产记录、批检验记录、放行审核记录、仪器设备使用等与批产品有关的记录,普通留样记录。 | 保存至产品有效期。 |
仓储类记录:仓储实物帐册、取样记录、销售发运记录等。 | |
质量类记录:客户投诉、质量回顾、培训记录、审计、供货商、验证(确认)、风险评估记录等。 | 保存至产品有效期。 |
设备类记录:维护检修、校准记录。 | 保存至仪器设备的使用周期结束。 |
其他辅助性的记录和日志。 | 应根据其记录的目的确定保存时限 |
作废文件 | 保存3年 |
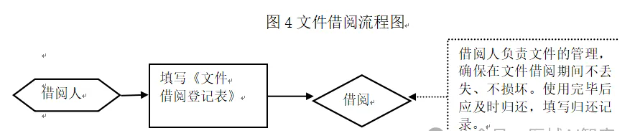
4.13 文件借阅
4.14文件格式
4.14.1页眉
4.14.1.1首页页眉形式
注册商标 | 文件名称(黑体,四号) | ||
文件编号:(黑体,五号,下同) | |||
起草/修订人: | 日期: 年 月 日 | 分发部门:
| |
审核人: | 日期: 年 月 日 | ||
批准人: | |||
执行日期: 年 月 日 | |||
4.14.1.2其它页页眉形式
注册商标 | 文件名称(黑体,五号,下同) |
文件编号: |
4.14.1.3 页眉行距:固定值80mm。
4.14.2 页脚
“第X页 共X页”(宋体,小四,居中)
4.14.3 正文格式
1、目的 宋体,小四号字
2、适用范围 宋体,小四号字
3、职责 宋体,小四号字
4、内容 宋体,小四号字;流程图中文字采用宋体五号字。
行距:1.5倍
4.14.4 文件页边距
上20mm ,下20mm,左25mm,右20mm,装订线宽5mm,装订位置:左。
4.15 记录格式
4.15.1 页眉形式
**有限公司(黑体 五号)
**/REC-ZL-001-A/0
4.15.2记录正文
文件名称(宋体加黑 四号)
记录内容(宋体,五号) | ||||
4.15.3 记录页边距
纵向记录:上12mm ,下20mm,左20mm,右20mm,装订位置:左。
横向记录:上12mm ,下20mm,左20mm,右20mm,装订位置:上。
 售前咨询专员
售前咨询专员