深度解析:可吸收性外科缝线FDA 510k注册方案
外科缝线分为可吸收性和非吸收性,可吸收性缝线又分为天然材料可吸收性缝线和合成材料可吸收性缝线。每一个产品类别都有其产品代码和符合的法规条款。如下:
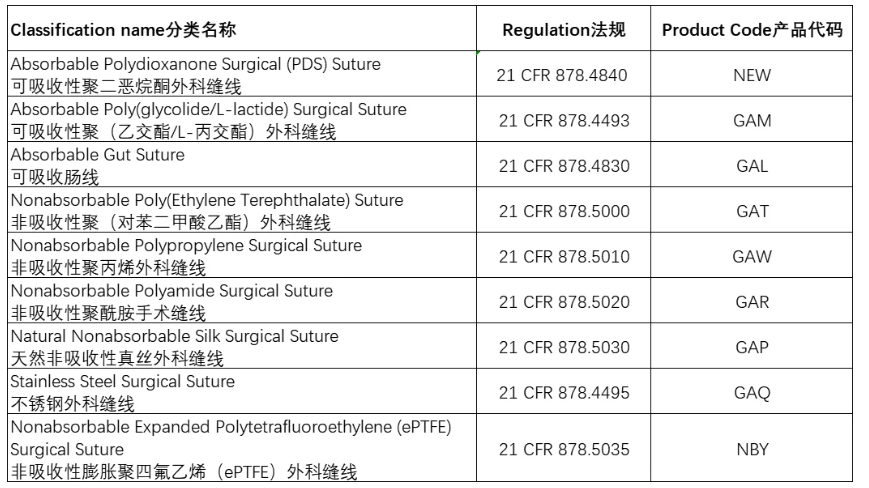
以下我们就以可吸收性聚二恶烷酮(PDS)外科缝线为例,思考FDA注册方案。
Device Classification产品分类
产品名称:可吸收性聚二恶烷酮(PDS)外科缝线
Classification name 分类名称:Absorbable polydioxanone surgical suture
Regulation 法规:21 CFR 878.4840
Device Classification 器械分类:Class II
Product Code 产品代码:NEW
Review Panel 审查小组:General & Plastic Surgery 普通外科与整形外科
Description of device 产品描述
Absorbable polydioxanone surgical suture is an absorbable, flexible, single-use, sterile, monofilament thread prepared from polyester polymer poly (p-dioxanone). It may be coated or uncoated, undyed or dyed, and with or without a standard needle attached.
可吸收聚二恶烷酮外科缝线是一种可吸收、易弯曲、一次性使用、无菌、单丝线,由聚酯聚合物聚(对二氧环酮)制成。它可以有涂层或无涂层,未染色或染色,并附有或不附有标准针。
Intended use/Indications for use 预期用途/适应症
Absorbable polydioxanone surgical suture is intended for use in soft tissue approximation, including pediatric cardiovascular tissue where growth is expected to occur, and ophthalmic surgery.
可吸收的聚二恶烷酮外科缝线适用于软组织的对合修复,包括预期存在生长需求的儿科心血管组织,以及眼科手术。
Comparison to Predicate 与等同器械的对比
可从以下方面与Predicate Device等同器械进行对比,论证SE实质等同性。
Product Code/Regulation 产品代码及符合的法规条款;
Intended Use预期用途;
Indications for Use适应症 ;
Suture Material 缝线材质(Polydioxanone 聚二恶烷酮);
Suture Characteristics 缝线特征(比如 Synthetic absorbable monofilament with bidirectional barbs along the long axis 沿长轴具有双向倒刺的合成可吸收单丝 );
Sterilization methods 灭菌工艺( 比如Ethylene oxide 环氧乙烷灭菌,或者Gamma 辐射灭菌) ;
Thread Size 线规格(符合USP规格描述);
Thread coating 线涂层;
Thread length 线长;
Dyeing of Thread 线染料(Undyed 未染色或染料符合USP标准);
Contact Type接触类型(植入 Implant, 可吸收Absorbable );
Contact Duration接触时间( >30 Days );
Needle Materials针材质(Stainless Steel (SUS 304) needle不锈钢 );
Needle Coating 针涂层;
Absorption time 吸收时间;
Self-life 有效期;
Performance testing 性能测试
参考以下标准:
USP <881> Tensile Strength 断裂强力
USP <861> Sutures-Diameter 直径
USP <871> Sutures-Needle Attachment 针线连接强力
ASTM F1874 Bending test 弯曲试验
ASTM F3014 Penetration Testing 穿刺性能
USP <71> Sterility Tests 无菌测试
测试项目包括:
Diameter 直径;Length 长度;Tensile Strength 断裂强力;Needle Attachment 针线连接强力;Extractable Color 可萃取颜色;Needle corrosion resistance testing 针耐腐蚀测试;Needle flexural stress testing 针弯应力测试;Needle penetration testing 针穿刺测试;Sterility Tests无菌
Resorption Profile 可吸收特性
在体内或体外证明最终灭菌可吸收外科缝线的吸收特性。可吸收特性应包括记录外科缝线的吸收速率、至完全吸收时间、随时间变化的残留断裂强力。可吸收特征应以图表、表格或图形形式呈现,以说明缝线在具有临床意义的时间段内的残留断裂强力。具有临床意义的时间长度取决于可吸收外科缝线的预期用途。
Biocompatibility Testing 生物相容性测试
根据外科缝线的预期用途(缝合部位),确定外科缝线的接触类型、持续时间(与组织/骨骼以及血液长时间或持久接触的植入器械)。
参考标准:ISO 10993-1 《医疗器械的生物学评价. 第1部分: 在风险管理过程内的评价与试验》
<Biological evaluation of medical devices — Part 1: Evaluation and testing within a risk management process>
参考文章:医疗器械生物相容性 | 如何根据产品特性选择合适的测试项目?
考虑以下生物相容性终点:
Cytotoxicity 细胞毒性 ISO 10993-5 <Biological evaluation of medical devices — Part 5: Tests for in vitro cytotoxicity> Sensitization 致敏性 ISO 10993-10 <Biological evaluation of medical devices — Part 10: Tests for skin sensitization and irritation> Intracutaneous Reactivity
皮内反应 ISO 10993-23 <Biological evaluation of medical devices — Part 23: Tests for irritation> Acute systemic toxicity 急性全身毒性ISO 10993-11 <Biological evaluation of medical devices — Part 11: Tests for systemic toxicity> Material-mediated pyrogenicity 材料介导热原ISO 10993-11<Biological evaluation of medical devices — Part 11: Tests for systemic toxicity> Subacute and subchronic toxicity 亚急性/亚慢性毒性 ISO 10993-11 <Biological evaluation of medical devices — Part 11: Tests for systemic toxicity> Genotoxicity 遗传毒性 ISO 10993-3 <Biological evaluation of medical devices — Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity> Implantation 植入反应 ISO 10993-6 <Biological evaluation of medical devices — Part 6: Tests for local effects after implantation> Chronic toxicity 慢性毒性 ISO 10993-11<Biological evaluation of medical devices — Part 11: Tests for systemic toxicity> Carcinogenicity 致癌性 ISO 10993-3 <Biological evaluation of medical devices — Part 3: Tests for genotoxicity, carcinogenicity and reproductive toxicity> Degradation 降解 ISO 10993-9 <Biological evaluation of medical devices — Part 9: Framework for identification and quantification of potential degradation products>
如果和血液接触,还需考察血液相容性 ISO 10993-4 <Biological evaluation of medical devices — Part 4: Selection of tests for interactions with blood
Sterility 无菌性/灭菌验证
应证明器械的无菌性或灭菌能力达到 10^-6 无菌保证水平。
参考文章:FDA注册 | 无菌医疗器械510(k)提交资料必须包括哪些信息?
参考标准:
FDA指南《标注为无菌的器械在上市前通知(510(k))提交中无菌信息的提交与审查指南》
环氧乙烷灭菌 ISO 11135-1 <Sterilization of health-care products — Ethylene oxide — Requirements for the development, validation and routine control of a sterilization process for medical devices>
辐射灭菌 ISO 11137-1 <Sterilization of health care products — RadiationPart 1: Requirements for development, validation and routine control of a sterilization process for medical devices>
Packaging Validation 包装验证
应提供包装(无菌屏障系统)描述及其如何保持器械无菌性,以及包装测试方法描述。
参考文章:FDA注册 | 无菌医疗器械包装验证全攻略:10大关键测试标准与最新版本
微生物屏障 DIN 58953-6:2023 <Testing of Containers for Medical Devices – Part 6: Determination of Microbial Barrier Properties>
真空泄漏 ASTM D3078-02(2021)e1<Standard Test Method for Determination of Leaks in Flexible Packaging by Bubble Emission>
密封强度 ASTM F88/F88M-23 <Standard Test Method for Seal Strength of Flexible Barrier Materials>
染料渗透 ASTM F1929-23 <Standard Test Method for Detecting Seal Leaks in Porous Medical Packaging by Dye Penetration >
模拟运输 ASTM D4169-23e1 <Standard practice for performance testing of shipping containers and systems>
Shelf Life货架有效期验证
货架有效期对至少三个生产批次的老化器械进行测试。
参考标准:ASTM F1980《医疗器械无菌屏障系统加速老化的标准指南》
Usability Testing 可用性测试
参考指南:<FDA Guidance:Applying Human Factors and Usability Engineering to Medical Devices> FDA指南:人因工程与可用性工程在医疗器械中的应用
Labeling 标签
标签应符合21 CFR Part 801及FDA无菌指南的要求。
 售前咨询专员
售前咨询专员