多款医疗器械进入创新审批通道
根据《创新医疗器械特别审批程序(试行)》,我国医疗器械创新审批是为了保障医疗器械的安全、有效,鼓励医疗器械的研究与创新,促进医疗器械新技术的推广和应用,推动医疗器械产业发展的特殊审批通道。
据高端医械院数据中心统计,2025年1季度全国进入创新特别审批通道注册产品共计57项,包括54项国产注册产品,3项进口注册产品。
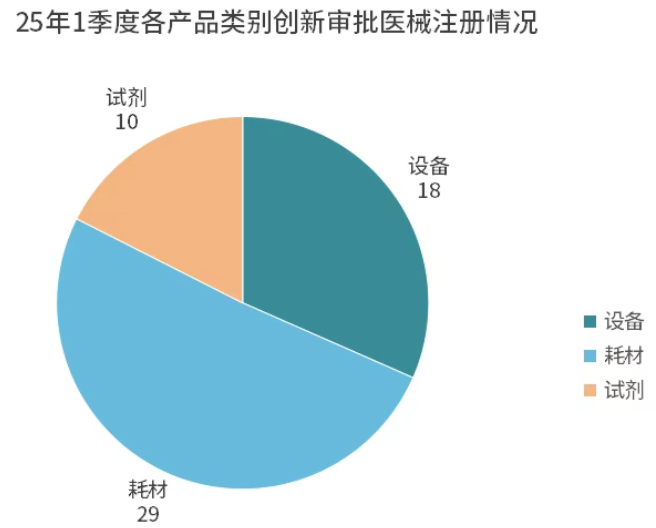
从产品类别来看:包括18项器械设备产品,10项试剂产品,29项耗材产品。
数据来源:高端医械院数据中心
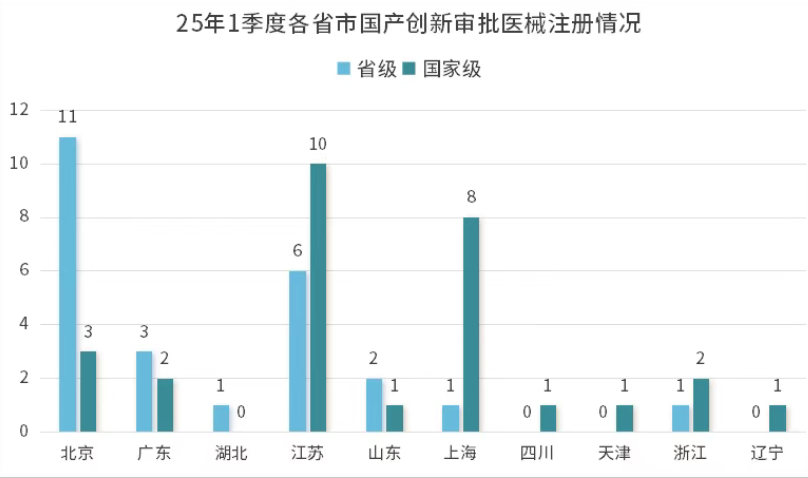
2025年1季度,仅有美国及德国分别注册了2款、1款进口创新审批医疗器械,其余全为国产器械。
近年来,我国围绕创新医疗器械领域发布了一系列利好政策,从多个维度发力,力求推动行业从仿制迈向自主研发,增强国际竞争力。
01审评审批加速与流程优化
国家药监局针对创新医疗器械开通重大技术问题咨询通道,创新产品预审查机制应运而生。企业在完成临床前研发后,即可提前申请临床试验方案预审查,大大缩短了审批周期。
不仅如此,临床试验审批也在提速,北京等地明确将临床试验项目启动时间压缩至20周以内,并计划在2025年新获批创新药械产品不少于15个。
数据对比更直观地展现出这一政策导向下的成果。去年一季度,创新注册数量为45项,其中国家级18项,省级27项;而今年1季度,创新注册总数攀升至57项,其中国家级达到32项,省级25项。
国家级创新注册数量的大幅增长,凸显出政策对高端创新产品的推动作用,更多具备核心技术的产品在加速审批通道下脱颖而出。
02全生命周监管与重点领域支持
高值耗材中,心脏支架国产替代率已达80%,血液灌流器更是高达90%。这一成就得益于集采政策推动,例如国家冠脉支架集采后,国产企业乐普医疗、微创医疗等通过价格优势和技术迭代快速抢占市场。此外,国产产品在临床效果上已与进口产品无明显差异,性价比优势显著。
鼓励企业联合高校、科研院所及医疗机构组建研发机构,并强化知识产权保护,例如上海对进入国家和市级创新特别审查程序的产品,最高给予800万元支持。“十四五” 规划明确到2025年要显著提升医疗装备产业链现代化水平,目标是培育6-8家全球医疗器械50强企业,国产替代上升至国家战略高度,《医疗器械管理条例》修订后,进一步凸显了创新的重要地位。
04医保与采购政策倾斜
医保与采购政策也向创新医疗器械倾斜,广州出台“十条措施”,要求医疗机构定期开展采购会议,优先选用创新医械并将配备率纳入绩效考核;海南将创新医械纳入医保直接结算,北京、上海等地设立专项资金,支持多元支付机制,且创新医疗器械暂不纳入集采范围,降低企业短期市场风险的同时,医保部门对创新产品的支付态度也日益积极。
新版条例将临床试验能力和条件纳入医疗机构等级评审并明确审批时限,鼓励医院参与;允许二类、三类医疗器械注册使用自检报告,有效降低企业研发成本。
区域政策与资金支持同样给力,浙江借助审批流程优化和医保支持加速产品上市;北京规划到2026年医药健康产业规模达1.25万亿元;上海对创新医械研发投入给予最高40%补贴。国家发改委等部委更是提供超8000亿元融资,重点支持医疗器械创新平台和重大工程等新兴产业集群。
尽管政策密集出台,但中国在创新审批机制、理论基础等方面仍与美国存在差距,且行业存在产品同质化问题。未来需进一步强化基础研究、优化创新生态,以实现从“中国制造”到“中国创造”的跨越。
上一篇:【CMDE】首个数字PCR领域三类创新医疗器械注册技术审评报告公开
下一篇:没有了!
 售前咨询专员
售前咨询专员