医疗器械注册人制度
在产学研转化过程中,注册人委托生产的制度至关重要,医疗器械注册人制度应运而生。该制度是国际社会普遍采用的现代医疗器械管理制度。本文仅作简要介绍。
医疗器械生产的一般流程如下:
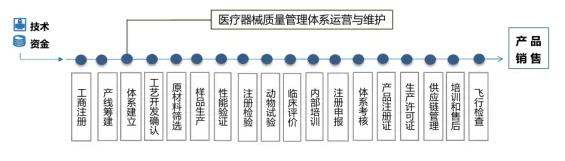
研发、生产、销售的主体皆可分离,研发主体结合符合GMP规范的厂房进行资源匹配,激活资源,实现科研转化,促进医疗器械产业的发展。
在中国,注册人制度2018年开始,国家药监局启动了医疗器械注册人制度试点工作,试点范围达到了22个省、自治区、直辖市。试点工作主要围绕以下几个方面展开:一是科研机构是否可以成为医疗器械注册人。二是注册人委托生产时,与受托人之间的权利、义务如何划分。三是异地委托生产时,监管部门的权力和责任如何配置。四是注册人全生命周期的责任如何有效落实。
新《医疗器械监督管理条例》总结了这几年试点的经验,进一步明确了医疗器械注册人制度的核心内容。
第一,基本定位。《条例》明确规定,医疗器械注册人、备案人应当加强医疗器械全生命周期质量管理,对研制、生产、经营、使用全过程中医疗器械的安全性、有效性依法承担责任。
第二,在生产环节方面。《条例》规定,医疗器械注册人、备案人可以自行生产也可以委托具备相应条件的企业生产。委托生产的,注册人、备案人应当对所委托生产的医疗器械质量负责,加强对受托生产行为的管理,保证其按照法定要求进行生产。这里还要强调一点,具有高风险的植入性医疗器械不得委托生产。
第三,在经营环节方面。医疗器械注册人、备案人要监督经营企业建立健全与经营的医疗器械相适应的质量管理体系,并保证其有效运行;从事网络销售的,应当符合网络销售的有关规定。
第四,在不良事件监测方面。《条例》规定,医疗器械注册人、备案人应当建立医疗器械不良事件监测体系,对不良事件及时开展调查和处置。新《条例》规定医疗器械注册人、备案人应当主动开展已上市医疗器械的再评价,根据再评价结果采取相应的风险控制措施。
 售前咨询专员
售前咨询专员