【官方回复】医疗器械可以先送检,再进行灭菌确认吗?
时间:2025-07-03 访问量:1010
众所周知,医疗器械必须完成型式检验以后才能进行临床试验或者注册申报,型式检验通常时间比较长,有些企业想节省验证的时间,尽快做出样机送型式检验,导致验证时间比较长的灭菌验证通常想送检以后和形式检验同步进行,从法规角度这样可以吗?现在官方回复来了。
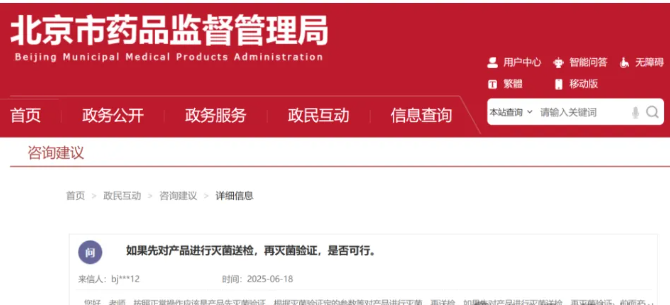
网民您好!关于您咨询的问题,经核实回复如下:根据《医疗器械注册质量管理体系核查指南》“4.5.5(设计转换) 申请人应当保留产品设计转换活动的所有记录,以表明设计和开发输出成为最终产品规范前已得到充分验证且适用于常规生产,并确保生产工艺在使用确定的原材料和设备条件下,持续稳定生产出符合预期用途和产品技术要求的产品。如:无菌提供产品的灭菌工艺及相关设备设施验证与确认、有源医疗器械基本安全和基本性能的实现确认评估、体外诊断试剂生产过程、工艺参数以及批量放大验证等。”企业应按照相关法规的要求,对灭菌工艺进行验证确认,保证设计和开发输出成为最终产品规范前已得到充分验证且适用于常规生产。应先进行灭菌工艺验证。送检验的产品应为按照确认好的灭菌过程进行灭菌并经企业检验合格的产品。北京市药品监督管理局 2025年6月18日



上一篇:医疗器械答疑汇总(五十六)
下一篇:没有了!
 售前咨询专员
售前咨询专员